Mieux comprendre la combustion et ce qu’affiche votre analyseur…
Le domaine de la combustion
© Jean-Marie THOMAS et Didier RÄÄS
Le domaine de la combustion a inspiré de très nombreux ouvrages professionnels écrits par des scientifiques, des centres de formation, des constructeurs ou encore par des auteurs libres. Nous ne prétendons absolument pas résumer cette littérature dans les lignes qui suivent. Notre objectif est de vous proposer des repères qui vous aideront à interpréter les données fournies par votre analyseur de combustion ECOM.
Le domaine de la combustion a inspiré de très nombreux ouvrages professionnels écrits par des scientifiques, des centres de formation, des constructeurs ou encore par des auteurs libres. Nous ne prétendons absolument pas résumer cette littérature dans les lignes qui suivent. Notre objectif est de vous proposer des repères qui vous aideront à interpréter les données fournies par votre analyseur de combustion ECOM.
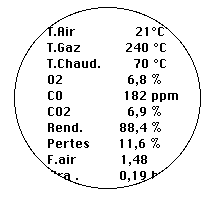
Lorsque votre analyseur affiche sur son écran des renseignements ou édite par son imprimante un justificatif, il comporte un certain nombre d’informations : O2, CO, CO2, etc.
Nous allons approcher un à un ces éléments et situer leurs rôles dans la combustion.
Nous allons approcher un à un ces éléments et situer leurs rôles dans la combustion.
La matière
Rappelons-nous que toute matière est composée d’un nombre considérable d’atomes (103 types différents), chaque atome comporte de 1 à 7 liaisons lui permettant de se lier à un autre atome, car seul il ne serait pas stable (exception faite de quelques-uns dits “ nobles “).
Corps simples de la combustion
- Le carbone, symbole C, constitué d’un atome, il peut se rencontrer dans la nature sous une forme très pure : le diamant. Combustible de base, il est souvent combiné avec l’hydrogène (hydrocarbures).
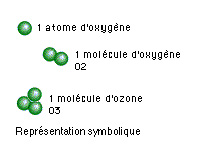
- L’oxygène, (symbole O Z = 8 m/a 15999) : l’air que nous respirons en contient pratiquement 20,8 % sous forme de molécule de deux atomes et s’écrit donc O2, l’atome d’oxygène est instable lorsqu’il est seul ou comprenant un troisième atome (O3 ou ozone) c’est l’élément actif et oxydant de la combustion.
- L’azote, (symbole N, Z = 7, m/a 14,0067), constitue la plus grande partie de l’air ambiante (78,2 %) sous forme de molécule de deux liaisons, N2, et se comporte comme l’oxygène, il ne participe pas à la combustion et apporte quelques inconvénient (chute de rendement, NOx…).
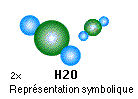
- L’hydrogène, (symbole H, Z = 1, m/a 1,008 ) : comme l’oxygène et l’azote sa molécule est constituée de deux atomes (H2) gaz inodore et incolore il est toujours combiné à d’autres atomes c’est un gaz très énergétique mais plutôt instable, sa combustion produit de l’eau H2O (H2 + 1/2 O2)
- Le soufre, (symbole S, Z = 16 m/a 32,064), il se conduit comme le carbone et par les produits de sa combustion devient un élément indésirable en produisant de l’anhydride sulfureux S + O2 = SO2, Avec d’excès d’air, à haute température il devient SO3 combiné avec l’humidité des fumées, il se transforme en acide sulfurique (H2O + SO3 = H2SO4).
Corps composés de la combustion
Entrant dans la combustion
- Tous les combustibles classiques.
- L’eau contenue dans les combustibles mais aussi dans l’air.
- L’air = 20,8 %d’oxygène + 78,2 % d’azote + des gaz rares (à peine 1%) argon, 0,9%, anhydride carbonique 0,03%, néon, hélium, krypton, hydrogène et xénon. Son poids et d’environ 1,3 kg par m3 à 0°C.
Produits de la combustion
- L’eau, symbole H2O, composée d’un atome d’oxygène et de deux atomes d’hydrogène.
- Le gaz carbonique (ou dioxyde de carbone), symbole CO2, constitué d’un atome de carbone lié à deux atomes d’oxygène.
Produits polluants
- Les NOx (appellation générale des oxydes d’azote) :
- NO qui s’oxyde rapidement et qui représente environ 95% des NOx.
- NO2 (ou dioxyde d’azote) environ 5% durée de vie quelques semaines.
- N2O (protoxyde d’azote) en infime partie, très stable, durée de vie plusieurs siècles.
- Le CO (ou monoxyde de carbone), un atome de carbone + un d’oxygène.
- Les SOx…
Combustibles gazeux
- Le méthane (CH4), principal constituant des gaz naturels.
- Les gaz naturels de Lacq, de Groningue, de la mer du Nord ou de Russie sont de même origine organique que le pétrole.
- Les gaz naturels du Sahara, liquéfiés pour leur transport et gazéifiés à leur arrivée au terminal (FOS, MONTOIR, Le HAVRE).
- Les gaz de pétrole liquéfiés (GPL) produits par la distillation du pétrole.
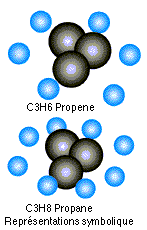
- Le propane, symbole chimique C3H8, composé de 3 atomes de carbone est de 8 atomes d’hydrogène : ce gaz entre pour 65 % dans la composition du propane commercial, la molécule est dite saturée (CnH2n+2)
- Le propène (C3H6) compose à 30% le propane commercial, sa molécule est dite insaturée CnH2n).
- Le grisou, gaz naturel du charbon.
- Les gaz de digestion ou biogaz provenant de la décomposition (lisier, marais, décharge…).
Combustibles liquides
- Les FOD (fioul domestique) ou FOL (fioul lourd) sont des produits de la distillation du pétrole.
- L’octane, symbole C8H18 autre produit du pétrole est une essence de traction etc.
Combustibles solides
- Le charbon, transformation anaérobie des végétaux.
- Le bois, la paille, la tourbe, etc.
Remarque
Nous venons de voir que la composition de toutes matières est un assemblage de molécules et donc d’atomes dans des proportions parfois très complexes : ainsi, l’octane n’entre qu’en partie dans la composition du « SUPER » de votre voiture. Les combustibles courant sont des « assemblages » et en fonction de la combinaison et de la masse atomique de chacun de leurs constituants, le taux de CO2 maximum peut être déterminé par calcul.Diagramme de combustion
A l’aide de ce taux de CO2 max. nous pourrons élaborer un diagramme de combustion de la forme d’un triangle rectangle dont la verticale (ordonnée) comportera un point représentant le CO2 maximum, appelé « point stœchiométrique ».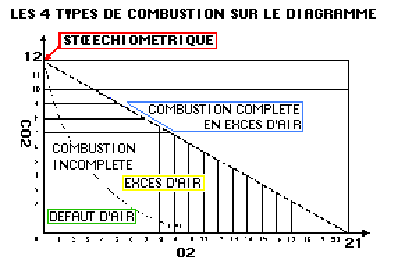
Sur la ligne horizontale (en abscisse), un point représentera le maximum d’oxygène dans l’air. La ligne qui joindra ces deux informations suivant une hypoténuse est appelée « droite de Combustion complète par excès d’air » ou droite de GREBEL, elle pourra être divisée en différents segments gradués en facteur d’air (ou encore en % d’excès d’air).
Ainsi pour le gaz naturel H (Haut pouvoir calorifique – c’est le cas des gaz russes, de mer du nord, de Lacq), nous construirons notre triangle par une droite verticale de 12 divisions (CO2 max. 11,7 à 11,9 %) et une droite horizontale de 21 divisions (teneur en oxygène de l’air 20,8%).
La combustion

Une combustion est la réaction chimique complète ou partielle du carbone et de l’hydrogène des combustibles usuels par oxydation de l’oxygène.
La combustion vive donne naissance à une flamme par réaction en chaîne, entretenue d’une manière plus ou moins limitée par l’apport de combustible ou de comburant. Cette réaction produit une combustion exothermique (c’est-à-dire qui dégage de la chaleur), du CO2 mais aussi de l’eau ainsi que d’autres composés plus ou moins agressifs.
L’oxydation est toute réaction intervenant entre des atomes ou molécules donneurs d’électrons et des atomes ou molécules accepteurs d’électrons : c’est un transfert d’électrons et d’énergie. La flamme est définie dans l’espace où s’effectue la plus grande partie de cette réaction (sensiblement la partie visible) et les gaz de combustion sont la prolongation de cette même réaction.
Les conditions de la combustion
Pour obtenir et entretenir une combustion il faut :
L’excès d’air est lié à la construction du ou des systèmes de combustion : induction atmosphérique ou brûleur soufflé.
Lors d’un réglage de la combustion, il faut tenir compte des variations de la quantité d’air donc d’oxygène : modification de la pression atmosphérique, température, encrassement… mais aussi des modifications du combustible : qualité, débit, température… Ces paramètres ne manqueront pas d’évoluer durant l’année de chauffe.
Pour s’assurer que ces dérives n’auront pas ou peu de conséquence dans le temps, on admet un excédent d’air plus ou moins important.
Par exemple pour une petite puissance, il sera de 1,2 à 1,25 soit un excès d’air de 20 à 25% (ou encore Lambda = 1,2 à 1,25).
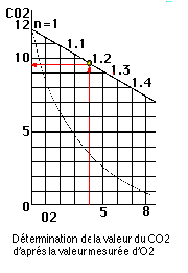
Revenons, pour l’exemple, à la droite de combustion complète du diagramme de gaz naturel : la valeur d’O2 est de 4%, le facteur d’air de 1,20 (20% d’excès d’air), dans ce cas, en partant de la droite de combustion complète, la correspondance en CO2 sera de 9,5 %.
On comprend l’importance de bonnes cheminées et ventilations dans une cuisine comme dans une chaufferie de plusieurs mégawatts.
Pour obtenir une meilleure performance, certaines installations fonctionnant au gaz naturel (et parfois aux GPL et au FOD) récupèrent la chaleur latente des gaz de combustion en les condensant soit à travers des chaudières à condensation ou en intégrant un ou plusieurs échangeurs à la sortie des générateurs dans le circuit des fumées.
Si les gaz de combustion sont refroidis pour être totalement condensés, le rendement est évalué sur P.C.S. (Pouvoir Calorifique Supérieur) mais sera exprimé par rapport au P.C.I. (par exemple 104%) sauf s’il est spécifié comme étant exprimé sur P.C.S.
Pour mémoire : calcul du rendement par la formule de SIEGERT :
Exemple : Ni CO, ni suie. CO2 9%, Tf °C des gaz 200, Ta °C de l’air ambiant 20, f pour GN 0,470 :
Rg = 100 – (f (Tf – Ta) / CO2)
Rg en % = 100 – (0,475 (200 – 20) / 9) = 90,5%
(f) et le coefficient dépendant du type de combustible est de l’excès d’air.
Un bon rendement de combustion est consécutif à :
Rendement global annuel : le bilan annuel intégrera dans le calcul le rendement global instantané et le besoin en chauffage de l’installation (degrés jour unifié).
Pour être analysés, les gaz de combustion sont asséchés par condensation ou absorption (filtres ou échangeurs type Peltier par ex.). Les mesures des gaz sont affichées en % pour l’O2, le CO2 et en ppm pour les CO, NOx et SOx.
Organisation de l’analyse des gaz de combustion (cas des brûleurs soufflés)
- Un combustible sous forme gazeuse (pour les liquides : ils seront pulvérisés ou vaporisés et pour les solides, ils seront chauffés très fortement pour en extraire les gaz.
- Un comburant en suffisance (d’où la nécessité d’une bonne ventilation : pour 10 kW il faudra 10 Nm3 d’air pour une combustion neutre (pour 500 th, 500 Nm3).
- Combustible et comburant seront mélangés dans les limites de l’inflammabilité (ex. pour les GN 5 à 14% dans l’air)
- Un point chaud d’amorçage, arc électrique, matière en ignition, flamme (environ 350°C pour le FOD, environ 650°C pour les GN).
- Une vitesse d’écoulement stable et suffisante (10 à 40 m/s) généralement en régime turbulent.
- La combustion stœchiométrique ou neutre, qui est la référence : elle n’est que théorique, toutes les techniques évoluées tentent de s’en approcher.
- La combustion complète par excès d’air ou oxydante, c’est-à-dire sans imbrûlé, ni solide ni gazeux, c’est la seule envisageable pour des brûleurs performants, c’est aussi l’objectif à atteindre dans le domaine du chauffage.
- La combustion incomplète avec excès d’air (semi-oxydante) ou en défaut d’air (semi-réductrice), à proscrire pour la santé et la sécurité, car pouvant produire du CO (imbrûlés gazeux) ou des suies (imbrûlés solides) préjudiciables à la santé.
Notions importantes à connaître
Excès d’air
L’oxygène est nécessaire pour assurer la totale oxydation du combustible mais dans la pratique il faudra assurer un mélange comportant une quantité d’air en excédant permettant à chaque molécule de combustible de réagir avec l’oxygène nécessaire à une combustion complète.L’excès d’air est lié à la construction du ou des systèmes de combustion : induction atmosphérique ou brûleur soufflé.
Lors d’un réglage de la combustion, il faut tenir compte des variations de la quantité d’air donc d’oxygène : modification de la pression atmosphérique, température, encrassement… mais aussi des modifications du combustible : qualité, débit, température… Ces paramètres ne manqueront pas d’évoluer durant l’année de chauffe.
Pour s’assurer que ces dérives n’auront pas ou peu de conséquence dans le temps, on admet un excédent d’air plus ou moins important.

Facteur d’air
Sur les diagrammes, l’excès d’air est fréquemment exprimé en facteur d’air. Le facteur d’air (Lambda) est égal à 1 au point stœchiométrique.Par exemple pour une petite puissance, il sera de 1,2 à 1,25 soit un excès d’air de 20 à 25% (ou encore Lambda = 1,2 à 1,25).
Revenons, pour l’exemple, à la droite de combustion complète du diagramme de gaz naturel : la valeur d’O2 est de 4%, le facteur d’air de 1,20 (20% d’excès d’air), dans ce cas, en partant de la droite de combustion complète, la correspondance en CO2 sera de 9,5 %.
Pouvoir comburivore
Pour une combustion neutre de 10 kW d’énergie, soit 1 m3 de gaz naturel ou un litre de fioul, il faudra 10 m3 d’air et en pratique 12 m3 (10 m3 + 20% d’excès d’air).Pouvoir fumigène
La combustion idéale (ou neutre) d’un m3 de gaz naturel donnera 1 m3 de CO2 + 2 m3 de vapeur d’eau + 8 volumes d’azote + un excès d’air + une augmentation de volume due à la température des gaz de combustion.On comprend l’importance de bonnes cheminées et ventilations dans une cuisine comme dans une chaufferie de plusieurs mégawatts.
Évolution des systèmes de combustion
Pour des puissances importantes, les technologies des systèmes de combustion ont évolué vers :- Une vitesse régulée d’injection des comburants et combustibles.
- Une maîtrise des proportions d’air et de gaz.
- Le contrôle et correction automatique de l’excès d’air (1 à 2%).
- La condensation des fumées.
- La saturation en eau de l’air comburant avec condensation.
- Le mélange de gaz de combustion avec l’air comburant.
Température de l’air comburant
La température de l’air ambiante évolue suivant les saisons, c’est une énergie gratuite que l’on déduit de la température des fumées pour calculer le rendement instantané du brûleur : ainsi, avec une température négative (- 5°C par ex.), ce rendement devrait être égal à celui obtenu avec une température positive (de + 20°C par ex.).Pour une plus grande stabilité de la combustion et du rendement, on réchauffe parfois l’air aspiré par le brûleur en le faisant circuler autour du générateur.
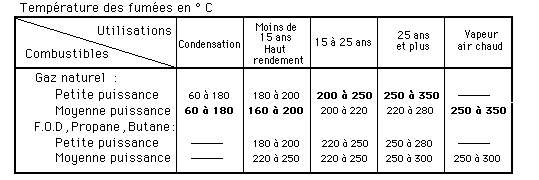
Température des fumées
Cette perte d’énergie est particulièrement utile pour les équipements traditionnels : elle est un des paramètres du calcul de la cheminée (vitesse ascensionnelle et la dépression nécessaire dans tous les cas pour l’évacuation des gaz de combustion), elle participe au maintien à l’état gazeux des vapeurs d’eau et autres composants contenus dans les fumées.Pour obtenir une meilleure performance, certaines installations fonctionnant au gaz naturel (et parfois aux GPL et au FOD) récupèrent la chaleur latente des gaz de combustion en les condensant soit à travers des chaudières à condensation ou en intégrant un ou plusieurs échangeurs à la sortie des générateurs dans le circuit des fumées.

Rendements de combustion
Rendement instantané
Par définition, c’est une grandeur lue et par convention, le rendement de combustion (RC) est exprimé en % sur P.C.I. (Pouvoir Calorifique Inférieur). L’hydrogène contenu dans les gaz de combustion reste en suspension si la température est plus élevée que le point de rosée (environ 60°C pour du gaz naturel).Si les gaz de combustion sont refroidis pour être totalement condensés, le rendement est évalué sur P.C.S. (Pouvoir Calorifique Supérieur) mais sera exprimé par rapport au P.C.I. (par exemple 104%) sauf s’il est spécifié comme étant exprimé sur P.C.S.
Pour mémoire : calcul du rendement par la formule de SIEGERT :
Exemple : Ni CO, ni suie. CO2 9%, Tf °C des gaz 200, Ta °C de l’air ambiant 20, f pour GN 0,470 :
Rg = 100 – (f (Tf – Ta) / CO2)
Rg en % = 100 – (0,475 (200 – 20) / 9) = 90,5%
(f) et le coefficient dépendant du type de combustible est de l’excès d’air.
Un bon rendement de combustion est consécutif à :
- L’absence d’imbrûlés (ni CO, ni suie)
- Au taux de CO2 le plus élevé
- A la température des gaz de combustion la plus basse.
Rendement utile
On ajoute aux pertes par les fumées celle des :- pertes par balayage à l’arrêt (porte, façade et chaudière non étanches).
- de la pré-ventilation et/ou de la post-ventilation.
- du rayonnement des générateurs (sans calorifuge ou jaquette).
Rendement global
Rendement global Instantané : le calcul s’effectue en divisant l’énergie consommée en combustible par celle produite et mesurée à la sortie des générateurs.Rendement global annuel : le bilan annuel intégrera dans le calcul le rendement global instantané et le besoin en chauffage de l’installation (degrés jour unifié).
L’analyse des combustions
- Un analyseur automatique intègre les paramètres de calcul en fonction du type de combustible sélectionné. Il mesure en général :
- Le taux d’oxygène et calcul en conséquence celui de CO2.
- Le taux de CO.
- La température des gaz de combustion et lui soustrait celle de l’air comburant.
Pour être analysés, les gaz de combustion sont asséchés par condensation ou absorption (filtres ou échangeurs type Peltier par ex.). Les mesures des gaz sont affichées en % pour l’O2, le CO2 et en ppm pour les CO, NOx et SOx.
Organisation de l’analyse des gaz de combustion (cas des brûleurs soufflés)
Combustibles liquides et solides :
- Mesure des brûlés solides (suie) ou des suspensions liquides : éventuellement les réduire voir les supprimer. À noter que dans certains cas le gaz naturel peut produire des suies, et le propane et butane plus sûrement encore.
- Mesure du CO : si le taux est trop élevé (+ 300 ppm), à réduire d’urgence.
- Mesure de l’oxygène ou du CO2
- Mesure de température d’air comburant (air ambiant) = Ta
- Mesure de température des fumées = Tf
- Mesure de la dépression de la cheminée = Dp
- Mesure de la dépression ou pression foyer = Pf
- Mesures complémentaires SO2, NO2, etc.
Pollutions dues à la combustion :
- Le CO2, responsable de l’effet de serre.
- Le CO (monoxyde de carbone), gaz combustible, détonnant à faible concentration, particulièrement sournois, toxique et très dangereux par ses effets irréversibles (Il détruit les cellules nerveuses de façon irrémédiable et peut être mortel suivant la concentration et l’intensité de l’activité durant le temps d’inhalation).
- Le SO2 (Oxyde de Soufre), sous forme gazeuse ou H2SO4 sous forme liquide : l’acide sulfurique, le SO2 se combine avec l’eau (H2O) contenus dans les fumées après condensation.
- Les poussières (suies, minéraux, sédiments) qui contribuent à l’effet de serre.
- Les NOx.
Pollutions générées par les transports à environ 76% et par la combustion à environ 17,5% :
- NO (monoxyde d’azote) s’oxyde rapidement et représente env. 95% des NOx Les fiouls contiennent à l’origine de l’oxyde d’azote en suspension, non maîtrisable à la combustion : chaque livraison nécessite un nouveau réglage du brûleur.
- NO2 (dioxyde d’azote) se forme au contact de l’air. Stable sur plusieurs semaines, il cause des maladies pulmonaires, une surproduction d’ozone à basse altitude. Condensé, il se combine à l’eau pour produire des pluies acides.
- N2O (protoxyde d’azote), très table, contribue à l’effet de serre, et détruit la couche d’ozone à haute altitude. Les quantités augmentent avec la température de la flamme et du foyer où elle se développe. Intervient également la vitesse de refroidissement.
- O3 (l’ozone) dont les effets nocifs, au niveau du sol, se font sentir vers 110 µg/m3 (avertissement de la population vers 180 µg/m3 et alerte vers 210 µg/m3). Le total des pollutions cumulées en COx, SOx, NOx, CnHm et suies ou poussières est d’environ 44 % pour les transports, de 43 %, pour l’industrie et le chauffage, et de 13 % pour l’agriculture et les divers autres émetteurs. Les mesures concernant les transports ont déjà permis de réduire la part de pollution de ceux-ci (pot catalytique, obligation de contrôle d’antipollution, diagnostic des véhicules de plus de 5 ans, etc.)
Rappelons que depuis le 20 Juin 1975, pour les chaufferies supérieures à 100 kW, un minimum de mesures est obligatoire :
- T° des gaz en sortie de cheminée (F.O.L.)
- Dépression (chaudière en…) – Indice de noircissement (sauf gaz) – 02 et CO2 (indicateur)
- T° des gaz en sortie de générateur (Indicateur).
Conclusion
Soyons des « pros » conscients et participons à l’effort pour aider à combattre pollution et gâchis :
- Par une meilleure maîtrise de la combustion avec moins de rejets d’imbrûlés (suies, poussières, CO, CO2, NOx…)
- Par l’utilisation d’énergies moins polluantes : réduction notable du SO2.
- Par un diagnostic des installations (comme pour les véhicules).
Avec pour résultats :
- Une modernisation du parc d’installations de chauffage
- La réduction des pertes inutiles avec de nouvelles chaudières.
- Une régulation plus performante des installations.
- La prise en compte de toutes les énergies.
- De nouveau système de combustion comme la réduction des NOx.
- Par des économies en besoin d’énergie (isolation, limitation, récupération…) qui reste le moyen le plus efficace de moins polluer.

 France
France